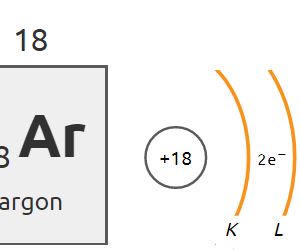
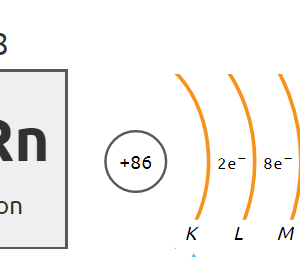
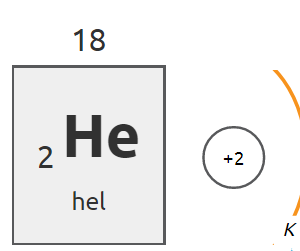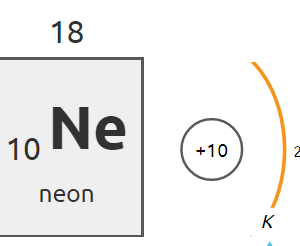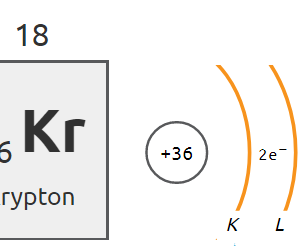Porównując właściwości pierwiastków, można zauważyć, że niemetale znajdujące się w 18. grupie układu okresowego (helowce, zwane gazami szlachetnymi) wykazują najmniejszą aktywność.
Helowce w zwykłych warunkach nie tworzą cząsteczek, a tylko niektóre z nich mogą tworzyć związki chemiczne, które są stosunkowo nietrwale.
Okazuje się, że konfiguracja elektronowa atomów helowców jest trwała.
Większość atomów pierwiastków, łącząc się ze sobą, dąży do uzyskania konfiguracji elektronowej najbliższego im w układzie okresowym helowca,
Przykład:
- atomy wodoru dążą do konfiguracji elektronowej helu,
- atomy chloru – do konfiguracji elektronowej atomu argonu.
Wśród helowców tylko atom helu ma 2 elektrony walencyjne nazywane dubletem elektronowym.
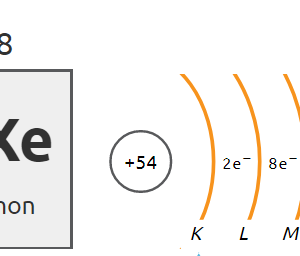
Atomy pozostałych gazów szlachetnych mają po 8 elektronów na ostatniej powłoce, tak zwany oktet elektronowy.
Liczba elektronów na ostatniej powłoce w atomach helowców
| Nazwa helowca | Liczba elektronów na ostatniej powłoce | Nazwa konfiguracji elektronowej ostatniej powłoki |
| hel | 2 | dublet elektronowy |
| neon | 8 | oktet elektronowy |
| argon | 8 | oktet elektronowy |
| ksenon | 8 | oktet elektronowy |
| radon | 8 | oktet elektronowy |