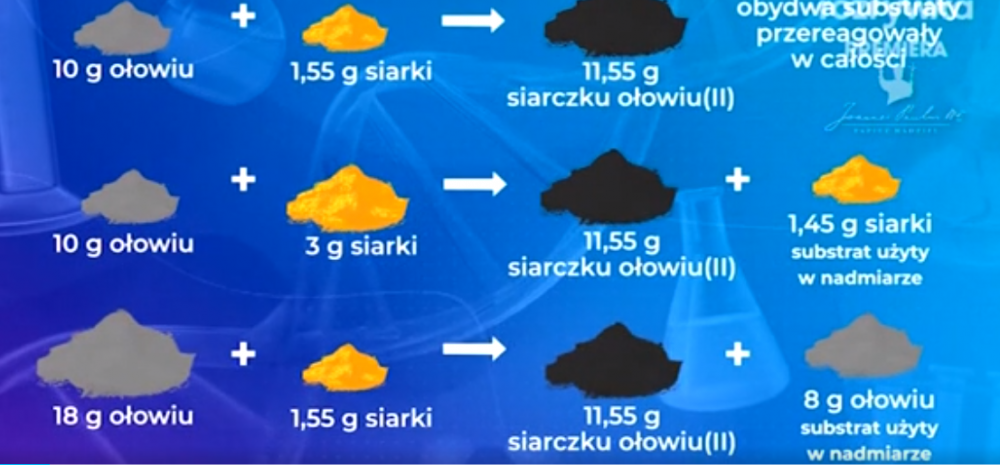
Prawo stałości składu związku chemicznego sformułował J.L. Proust i brzmi ono:
Skład związku chemicznego jest zawsze stały, tzn. stosunek wagowy pierwiastków wchodzących w skład określonego związku chemicznego jest zawsze jednakowy.
Pewna ilość substancji reaguje ze ściśle określoną ilością drugiej substancji.Każda cząsteczka składa się z określonej liczby atomów. Masa atomów jest stała i w reakcjach chemicznych nie ulega zmianie. Stosunki wagowe atomów w danej cząsteczce są stałe bez względu na metody otrzymywania danego związku.
-
Jakie informacje można odczytać ze wzoru sumarycznego?
skład jakościowy ( jakie pierwiastki tworzą związek chemiczny)skład ilościowy ( w jakim stosunku występują pierwiastki w związku chemicznym)2. Skład ilościowy można wyrazić w postaci:
a) stosunku atomowego - to liczba atomów poszczególnych pierwiastków w cząsteczce związku chemicznegonp. CO2liczba atomów C : liczba atomów O1: 2b) stosunku masowego – to stosunek iloczynów liczb atomów pierwiastków tworzących związek chemiczny i ich mas atomowychCO2masa C : masa O12u : 2x16 u12u : 32u 3 : 8c) stosunek procentowy to zawartość procentowa mas poszczególnych pierwiastków w związku chemicznym.
Oblicz skład procentowy tlenku żelaza (III) - Fe2O3