
Prawo zachowania masy (sformułowane przez Antoine,a i Michaiła Łomonosowa)
- Suma substancji, które biorą udział w przemianie chemicznej, jest równa sumie masy substancji powstałych w wyniku tej przemiany.
- Masa substratów zawsze jest równa masie produktów.
Masa substratów = Masa produktów
UWAGA
Reakcja musi zachodzić w układzie zamkniętym, ponieważ, gdyby produktem był gaz (np. wodór) w układzie otwartym "uciekłby" , co spowodowałoby, że masa otrzymanych produktów nie byłaby już taka sama, ale mniejsza.
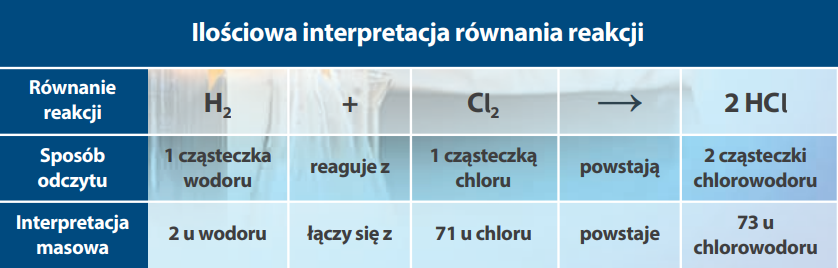
Zadanie1.
Ile gramów siarczku magnezu powstało w reakcji syntezy 24 g magnezu z 32 g siarki.
Rozwiązanie:
- Zapiszmy równanie reakcji podanej w treści zadania:
magnez + siarka —>siarczek magnezu
- Z prawa zachowania masy wynika równość:
masa magnezu + masa siarki → masa siarczku magnezu
- Zapiszmy jeszcze raz równanie reakcji i pod odpowiednimi substancjami wypiszmy dane z treści zadania
magnez + siarka —>siarczek magnezu
24g + 32 g= xg
Stąd: x=24g + 32 g= 56g
Odpowiedź: W reakcji powstało 56 g siarczku magnezu.
Zadanie 2
Oblicz ile tlenu zostało zużyte w reakcji spalania 3 g węgla, jeśli otrzymano 11g dwutlenku węgla.
Rozwiązanie:
węgiel + tlen → dwutlenek węgla
C + O2 →CO2
3g + x =11 g
x = 11 g - 3 g = 8 g
Odpowiedź: W reakcji wzięło udział 8 g tlenu.













